
近日,西湖大学的党波波团队研发了一种广谱 SARS-CoV-2 融合抑制剂,命名为A1L35HR2m-Chol,它能够在体外和体内广泛有效地抑制冠状病毒,并且对当前和新出现的 SARS-CoV-2 变种表现出强大的功效。该研究题为“An enhanced broad-spectrum peptide inhibits Omicron variants in vivo”,发表在Cell Reports Medicine杂志。

来源:https://doi.org/10.1016/j.xcrm.2024.101418
为了开发强效、广谱的抗冠状病毒抑制剂,研究人员首先通过相对较长的柔性接头(GGGGS)7将ACE2衍生的肽A1引入到HR2m肽的N端,生成A1-(GGGGS)7-HR2m (A1L35HR2m)。研究人员还通过交换 A1 肽和 HR2m 肽 (HR2mL35A1) 的位置或通过缩短接头长度来构建其他三种融合肽,以生成 A1L5HR2m 和 A1HR2m。所有四种融合肽均通过重组表达制备,并使用 SDS-PAGE 和液相色谱-质谱法对所得肽的纯度进行了表征。
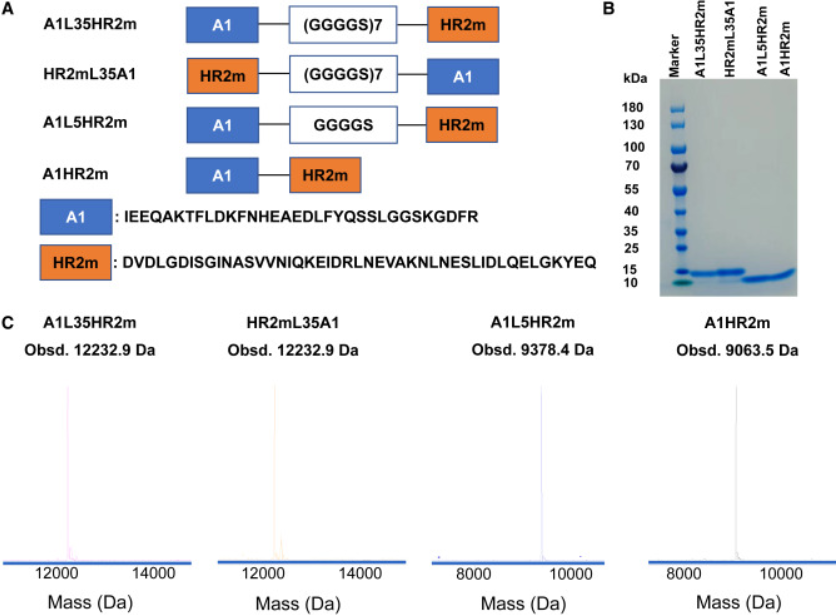
图1:A1L35HR2m、HR2mL35A1、A1L5HR2m 和 A1HR2m 的设计和特性
接下来,研究人员使用 SARS-CoV-2 假型病毒感染测定评估了 A1L35HR2m、HR2mL35A1、A1L5HR2m 和 A1LHR2m 的抑制活性。结果发现,在具有长柔性接头的 HR2m 肽的 N 末端添加 ACE2 衍生肽 A1 可以显著提高抗 SARS-CoV-2 活性。
接下来,研究人员采用 S 蛋白介导的细胞-细胞融合测定探索 A1L35HR2m 病毒抑制机制,结果发现 A1L35HR2m 有效抑制 SARS-CoV-2 D614G S 蛋白介导的 293T/EGFP/S 和 Caco-2 细胞之间的细胞融合,这些结果表明,A1L35HR2m 增强的抗 SARS-CoV-2 活性可能是由于其抑制 SARS-CoV-2 与靶细胞融合的能力提高。
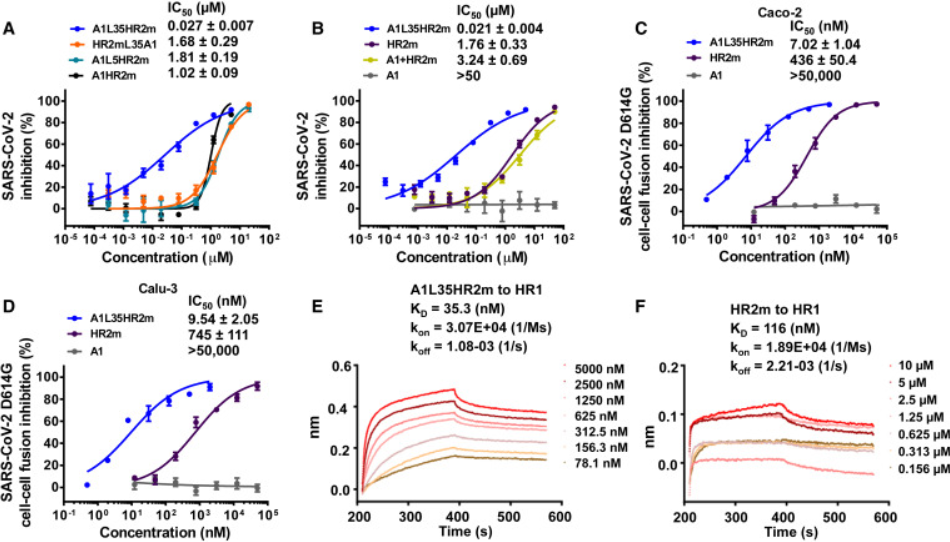
图2:将ACE2衍生肽A1与HR2m肽的N端缀合显著增强了对SARS-CoV-2感染的抑制活性
许多研究表明,SARS-CoV-2 HR2 衍生肽可以与 HR1 结构域产生竞争性相互作用,从而阻断病毒与靶细胞膜融合。为了研究 A1L35HR2m 中 A1 肽的引入是否会改变 HR2m 肽的原始功能,研究人员进行了生物层干涉测量 (BLI) 实验来表征 HR1 肽结合亲和力。结果发现,在A1L35HR2m中添加肽A1确实增加了HR1结合亲和力,这可能有助于提高病毒抑制活性。
以往的研究表明,HR2衍生肽的脂质修饰可以显著提高抗病毒活性。考虑到A1L35HR2m的抗病毒机制与HR2衍生肽相似,研究人员对A1L35HR2m的C端进行位点特异性修饰,生成A1L35HR2m-Chol。研究的结果表明,A1L35HR2m-Chol 对不同的 SARS-CoV-2 VOC、SARS-CoV 和 MERS-CoV 表现出广泛而有效的抑制活性。
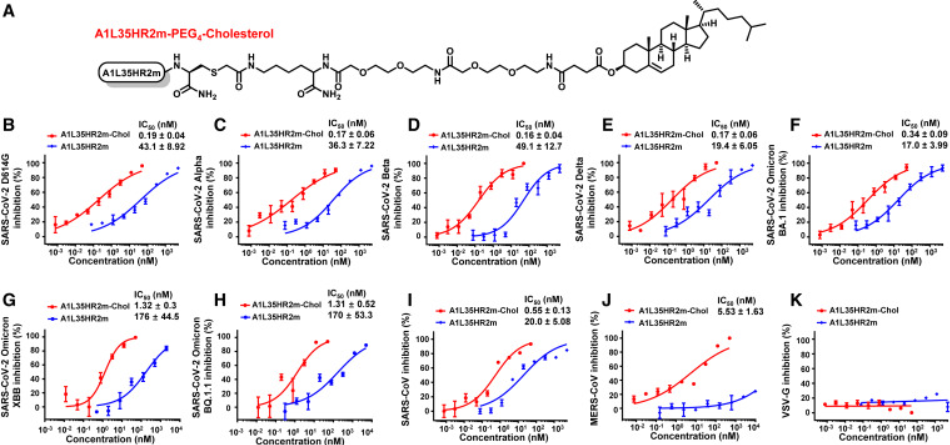
图3:A1L35HR2m-Chol广泛有效抑制假型冠状病毒感染
细胞毒性研究结果表明,A1L35HR2m-Chol 未表现出体外或体内毒性,低或高剂量的A1L35HR2m-Chol给药对小鼠的肝肾功能没有影响。
先前的研究表明,脂质HIV-1融合抑制剂可以增强离体抗HIV-1活性并提高体内稳定性。研究人员接下来探索了 A1L35HR2m-Chol 是否也表现出增强的离体抗 SARS-CoV-2 活性和延长的体内半衰期。
研究人员在肺、鼻和气管中发现了高浓度的 A1L35HR2m-Chol,这些器官与 SARS-CoV-2 感染过程特别相关。肺、鼻和气管中的肽浓度在 8 小时达到峰值。这些结果表明Chol缀合至A1L35HR2m的C末端可以显著延长体内半衰期。
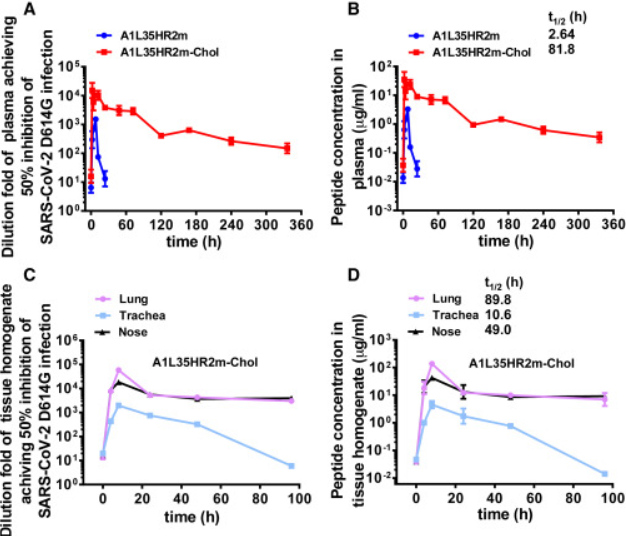
图4:肽处理小鼠血浆或组织匀浆样品中的离体抗SARS-CoV-2 D614G活性和肽浓度
最后,研究人员评估了A1L35HR2m-Chol 对Omicron BA.2.12.1 和 BA.5菌株的抗病毒功效。结果表明,A1L35HR2m 可抑制 BA.2.12.1 和 BA.5 复制,A1L35HR2m-Chol 也可以有效抑制 BA.2.12.1 和 BA.5 复制。此外,A1L35HR2m-Chol在抑制真正的Omicron BA.2.12.1 和 BA.5感染方面比A1L35HR2m(IC 50)更显著有效。
在研究过程中,Omicron EG.5.1 成为了 SARS-CoV-2 的主要毒株。然后作者评估了 A1L35HR2m-Chol 针对 Omicron EG.5.1 的抗病毒功效。研究人员首先使用 VeroE6-TMPRSS2 细胞进行微量中和病毒载量测定。结果显示,A1L35HR2m-Chol 可显著抑制 EG.5.1 复制。总之,A1L35HR2m-Chol 可以在体外和体内有效抑制新出现的占主导地位的 EG.5.1 变体。
随着 SARS-CoV-2 继续在全球传播,新的变种仍在迅速出现,对当前的疫苗和治疗方法提出了重大挑战。病毒与靶细胞之间的膜融合机制在不同冠状病毒中非常保守,HR1结构域和HR2结构域之间的六螺旋束形成在驱动膜融合中起着关键作用。
总之,在本文中研究人员建立了一种显著提高 HR2 肽病毒抑制活性的方法,并且工程化的 A1L35HR2m-Chol 可有效抑制不同的 SARS-CoV-2 VOC、SARS-CoV 和 MERS-CoV。我们相信 A1L35HR2m-Chol 是一种有前途的抗病毒分子,可以在体外和体内广泛有效地抑制冠状病毒,它也将保留对未来出现的 SARS-CoV-2 变体的抑制活性,值得进一步的转化研究。
文章来源:生物谷
官网链接:https://www.bioon.com/
微信公众号二维码: